3D打印与静电纺丝技术打造心脏芯片新平台

传统药物研发困境:心脏毒性的 “拦路虎”
在新药研发的漫漫长路上,药物诱导的心脏毒性(DIC)宛如一只凶猛的 “拦路虎”,让众多有潜力的药物折戟沉沙。据统计,许多新药因DIC问题在临床试验后期失败,不仅耗费了大量的人力、物力和财力,更重要的是,让患者失去了及时用上有效新药的机会。目前,用于评估DIC的传统方法主要包括体外细胞二维培养模型和体内动物模型。然而,二维培养模型过于简单,无法模拟天然心脏组织复杂的三维结构和细胞间相互作用;动物模型又因种属差异,难以准确预测药物对人体心脏的真实影响。这就好比用一把不合适的尺子去丈量,得到的结果自然难以令人满意。
心脏芯片技术:曙光初现
器官芯片技术的出现,为体外药物筛选带来了新的希望之光。其中,心脏芯片(HoC)作为模拟心脏生理功能的微型系统,能够在体外构建出与真实心脏环境高度相似的模型,为药物研发人员提供了一个精准研究药物心脏毒性的有力工具。但是,传统的心脏芯片在模拟天然心肌组织的各向异性结构方面存在明显不足,就像一座设计不够完美的建筑,难以充分发挥其应有的功能。
3D打印与静电纺丝的巧妙结合
近期南方医科大学的广东省数字医学重点实验室和生物力学实验室发表了一项结合3D打印与静电纺丝技术构建心脏芯片的创新研究成果。研究人员利用3D打印技术,像一位技艺精湛的工匠,精心打造出微米级的支架框架,精准模拟心肌的交织解剖结构。随后,通过静电纺丝技术,在支架表面构建出分支排列的纳米纤维网络,如同为心肌细胞铺设了一条条有序的 “高速公路”,引导细胞沿着特定方向排列生长。这种多尺度心脏支架的诞生,为心肌细胞提供了一个极为适宜的生长微环境。
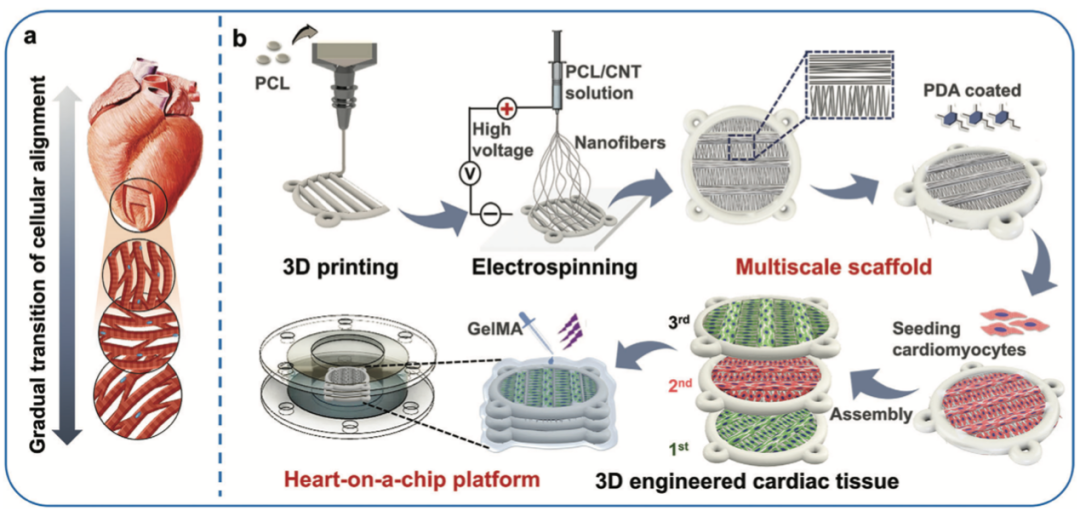
模仿心脏问题结构的脚手架的设计和制造。a)示意图显示了从心内膜到心外膜交织结构的对齐细胞层的渐进过渡。b)与3D打印和电纺技术集成的多尺度各向异性支架的制造,并进一步将工程心脏问题与微流体芯片平台相结合。(Liu et al., 2023)
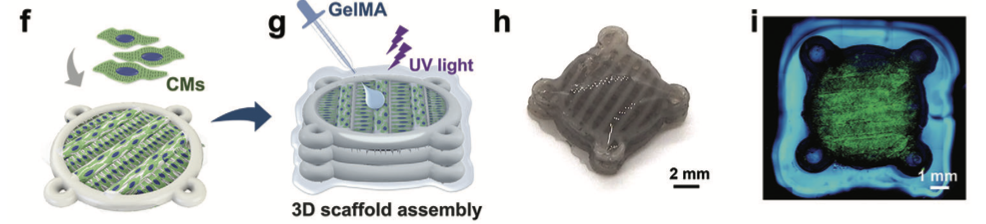
f)播种CMsona单层多尺度支架和g)制造3D支架的示意图过程,通过封装三层多尺度支架,在光交联后在GelMA水凝胶外壳中逐渐过渡。h)三层3D支架的粗和i)免疫荧光染色图像 (Liu et al., 2023)
在实验中,研究人员将原代心肌细胞(CMs)种植在这种多尺度心脏支架上,细胞展现出了良好的生物相容性,细胞活力高达90%!其中,4D4S支架组表现尤为突出,其独特的纳米纤维结构使得CMs能够更好地排列和伸长,细胞间的连接更加紧密,缝隙连接蛋白CX43表达显著提高,促进了心肌细胞的自发同步跳动,让心脏芯片更接近真实心脏的生理功能。
为了进一步模拟天然心肌的多层结构,研究人员受乐高积木的启发,设计出可堆叠的多尺度支架,并利用甲基丙烯酸明胶(GelMA)胶水通过光交联固定,成功构建出模拟天然心肌结构的3D多层各向异性支架。接着,将其巧妙地整合到微流控芯片灌注系统中,一个功能强大的3D各向异性HoC系统就此诞生。这个系统就如同一个微观世界里的 “智能心脏实验室”,不仅能够实时观察心肌细胞的跳动情况,还能通过计算流体动力学模拟,精准优化芯片设计,确定最佳灌注流速,为心肌细胞提供充足的营养和氧气,大大提高了细胞的存活率和活性。这个3D各向异性HoC系统的诞生,标志着心脏芯片技术在模拟真实心脏功能方面迈出了关键一步。它不仅克服了传统心脏芯片的局限性,更以其高度仿真的特性,为深入研究心肌细胞行为和药物作用机制提供了理想平台。 这种3D各向异性HoC系统凭借其出色的性能,为解决传统药物研发中心脏毒性评估难题带来了转机,也为其在实际药物研发场景中的应用奠定了坚实基础。
实际应用:精准评估药物心脏毒性
为了验证这个3D各向异性HoC系统的实际应用价值,研究人员以阿霉素(DOX)和右丙亚胺(DEX)为模型药物进行了测试。DOX作为一种常用的化疗药物,虽然在抗癌方面表现出色,但它的心肌毒性副作用却让医生和患者们头疼不已;DEX 则被认为可以对抗DOX的心肌毒性。在3D各向异性HoC系统中,研究人员清晰地观察到DOX对心肌细胞的损伤作用,以及 DEX对心肌细胞的保护效果,实验结果与临床实际情况高度吻合。这一成功验证,充分展示了该心脏芯片系统在评估药物心脏毒性和保护效果方面的强大能力,为药物研发过程中的早期安全性评估提供了一个高效、精准的体外检测平台。
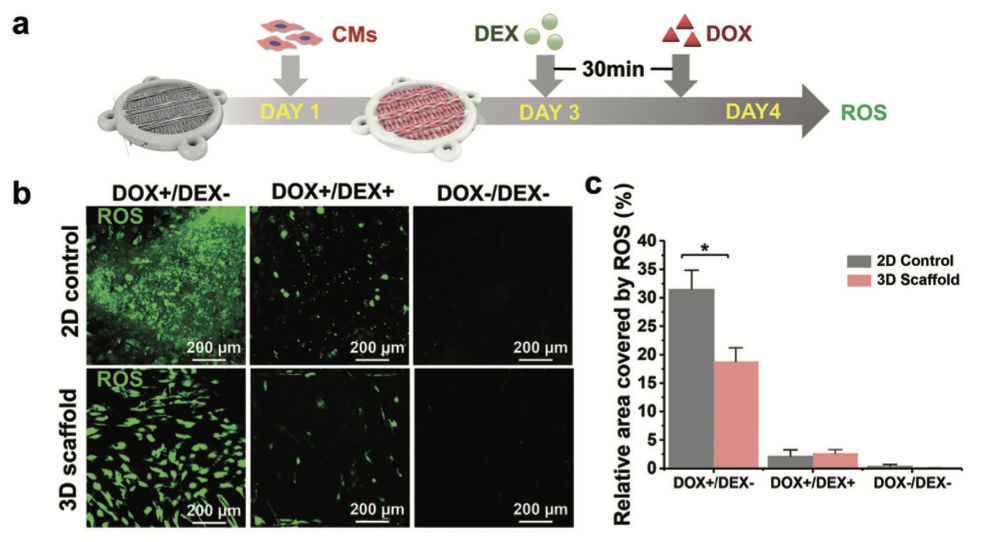
药物诱导的心脏毒性和心脏保护作用,使用3D多尺度支架进行心脏毒性和心脏保护作用。a)通过3D多尺度支架进行心脏毒性评估的示意图时间线。b)ROSon2D对照和3D多尺度支架的免疫荧光染色。c)ROS在2D对照和3D支架上所覆盖的相对区域的定量分析(Liu et al., 2023)
未来展望:助力医学飞跃
这项结合3D打印与静电纺丝技术的心脏芯片研究成果,无疑为构建3D生物工程心脏组织提供了全新的策略和思路。它所构建的HoC模型,将成为药物研发早期安全性评价的得力助手,大大提高药物研发的效率和成功率,让更多安全有效的新药能够更快地走向临床,造福广大患者。
参考文献
Liu S, Wang Z, Chen X, et al. Multiscale Anisotropic Scaffold Integrating 3D Printing and Electrospinning Techniques as a Heart‐on‐a‐Chip Platform for Evaluating Drug‐Induced Cardiotoxicity. Adv Healthcare Materials. 2023;12(24):2300719. doi:10.1002/adhm.202300719
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的高新技术企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。


