《Science》血管设计新算法让“3D打印心脏”更进一步

研究背景
当前生物制造技术在构建功能性大尺度组织时仍面临核心技术障碍,尤以血管网络的重建问题最为突出。血管系统不仅负责营养物质和氧气的输送,同时对维持细胞生存、实现组织功能具有关键作用。然而,目前主流的格栅式通道结构难以在非凸或复杂几何中实现高效均匀灌注,且灌注效率与生物性能存在严重局限。

为此,斯坦福大学团队提出一种基于物理建模算法的数字生成方法,能够快速、自动化地生成具备闭合结构的三维合成血管网络。该方法适用于任意体素几何中构建高效灌注路径,并可集成至CFD仿真和三维打印流程中,具有广泛的工程实用前景。
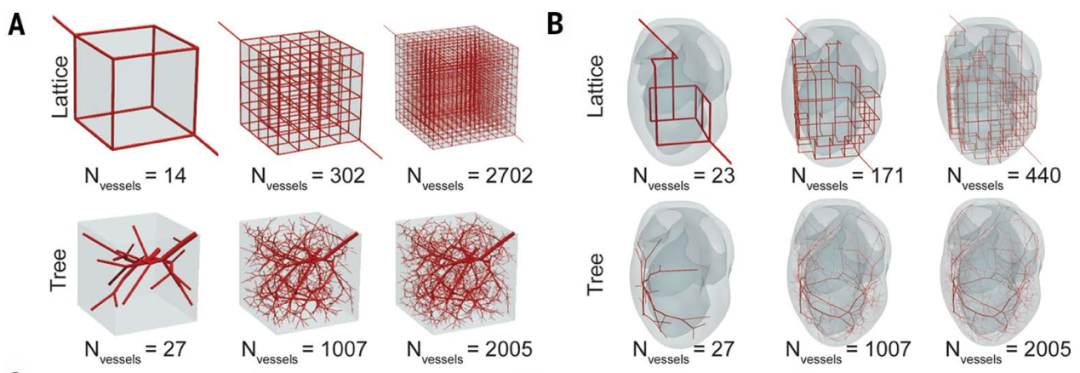
在凸(立方体)和非凸(双脑室)结构域中固定总血体积的代表性晶格和合成血管网络 (Zachary et al., 2025)
建模方法
本研究基于CCO(Constrained Constructive Optimization)算法框架进行开发与拓展。原始CCO算法虽具有一定生理合理性,但在多末端构建、大尺度封闭网络生成中存在计算效率与局部碰撞问题。
研究者引入以下关键建模改进:
引入Partial Binding机制以提高空间布线适应性
增加碰撞检测与体素遮挡机制,用于非凸几何体内血管路径的合理规避
引入Partial Implicit Volume辅助网络闭合
应用局部几何剪裁策略,提高节点合并效率
通过上述策略,单次生成千级末端血管的模型时间从60小时缩短至15分钟,算法加速达230倍。
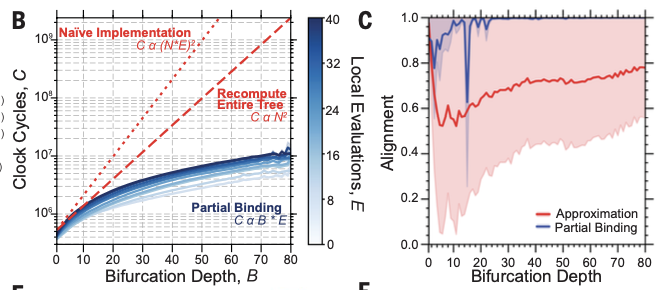
B)之前报告的分叉优化方案与部分结合方法(蓝色)的理论缩放复杂性(红色)。图参考完全、平衡的树的分叉深度(阴影:±2 SD,N = 100)。(C)对齐精度与部分结合的高分辨率有限差解(蓝色)和先验近似(红色)。实线显示中位数对齐(阴影跨度最小-最大对齐;N = 100)。所有树木在立方体灌注量内产生8000个出口 (Zachary et al., 2025)
灌注效率与传质性能评估
研究中构建多个非凸三维几何模型(如器官形体、空心环结构、脑回仿形结构),并分别对格栅网络与新生成的合成血管网络进行三维CFD流体仿真。主要评估指标包括:
灌注区域覆盖率
血流速度均匀性
氧气浓度分布梯度
总体压降与能耗比
模拟结果表明,合成血管网络在复杂几何中具有更优的灌注均一性与有效覆盖性,能够实现更为连续的溶质分布,降低局部缺氧区域的出现。
从建模到制造:自动化流程
该研究提出一条完整的数字血管制造流程链条,包括:
用户上传三维体积模型(如.obj或.stl)
系统自动生成血管网络拓扑与几何参数
同步导出多精度CFD仿真模型(0D/1D/3D可选)
自动生成3D打印文件(如.stl及切片文件)
上述流程通过SimVascular与自研工具链完成整合,并在复杂器官几何(如大脑皮层、心室、空腔环状结构)中完成实测验证。
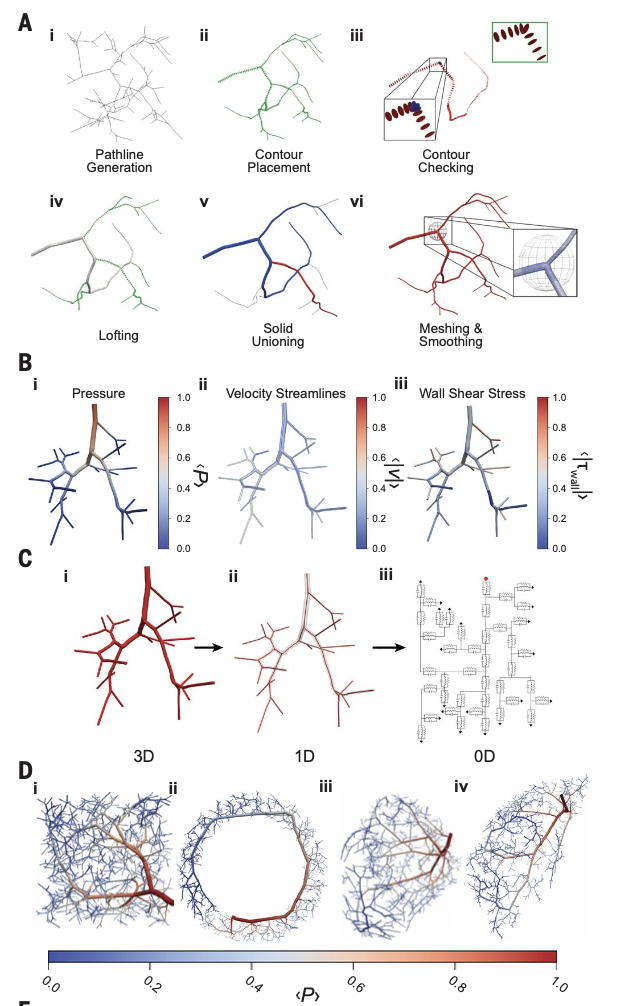
A)从离散合成容器中自动生成3D水密模型的主要步骤。(B)从具有稳定流入曲线的三维有限元法模拟中获得的标准化压力⟨P⟩、沿流线的速度⟨v⟩和壁剪切应力大小⟨| |τwall||⟩。(C)从原始3D模型文件中提取的降序1D和0D模型的插图。平均标准化压力⟨P⟩。(D)和流量⟨Q⟩ (Zachary et al., 2025)
实验验证
采用FRESH(Freeform Reversible Embedding of Suspended Hydrogels)打印工艺,研究团队将构建好的血管网络在支持水凝胶中进行打印,随后进行灌注实验与细胞活性分析。主要结果包括:
血管结构连续、无断裂,灌注过程稳定
组织芯部区域细胞活性显著高于格栅对照组(417倍提升)
细胞分布符合灌注模拟预测,验证CFD仿真准确性
该实验证明该模型生成的血管网络在结构上具备良好的生物制造兼容性,在功能上可显著提升厚组织中的细胞生存效率。
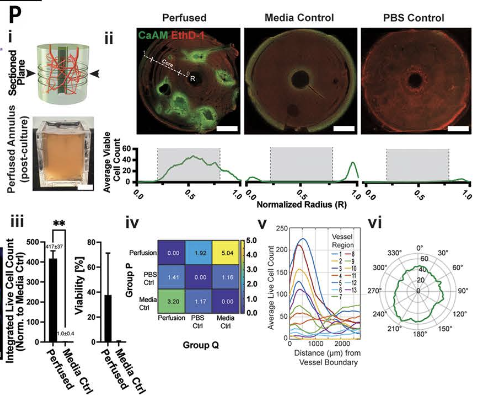
血管化环生率:(i)7天后的剖平面(顶部)和培养环(底部;刻度条为1厘米);(ii)活/死(CaAM/EthD- 1)染色(顶部),归一化半径(R)和核心区域∈ [0.2至0.8]表示平均放射状细胞生存能力(底部)(N = 每个条件3个组织结构,比例条为1毫米);(iii)使用Welch校正的未配对T检验归一化到介质控制的核心区域内集成活细胞计数[灌注:37.8 ± 33.6%;介质控制:0.4 ± 0.4%)的比较(N = 3;**表示0.05 < p < 0.01);(iv)Kullback-Leibler发散度比较观察到的和近似分布;(v)通道附近可行细胞的空间分布;以及(vi)他在通道附近的极性渗透率 (Zachary et al., 2025)
总结
斯坦福大学团队研究建立了一种模型驱动的合成血管网络快速生成工具链,解决了传统灌注结构在复杂几何与大尺度组织构建中的适应性与效率瓶颈。该系统的多模块联动性与打印适配能力,使其具备在组织工程、生物制造及体外模型构建中推广应用的潜力。整体以“设计—仿真—制造—验证”为主线,具备较强的工程闭环特征,对推动血管化组织生物制造技术的标准化和规模化具有重要意义。
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的高新技术企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。


