《Advanced Functional Materials》多材料 DLP 生物3D打印构建可灌注异质水凝胶结构


研究背景
天然组织的复杂性不仅体现在细胞组成,更在于力学性能、结构拓扑的异质性。传统单材料 DLP 生物打印虽已实现软骨、血管等简单组织建模,但在模拟肝脏、骨骼、肌肉界面等复杂结构时面临瓶颈,即无法同时调控力学梯度、细胞分布及功能微环境。深圳大学孔甜甜团队在《Advanced Functional Materials》发表的研究,以 PEGDA-AAm 生物墨水为核心,通过多材料 DLP 技术构建了兼具力学多样性和可灌注网络的异质水凝胶,为突破这一挑战提供了新思路。
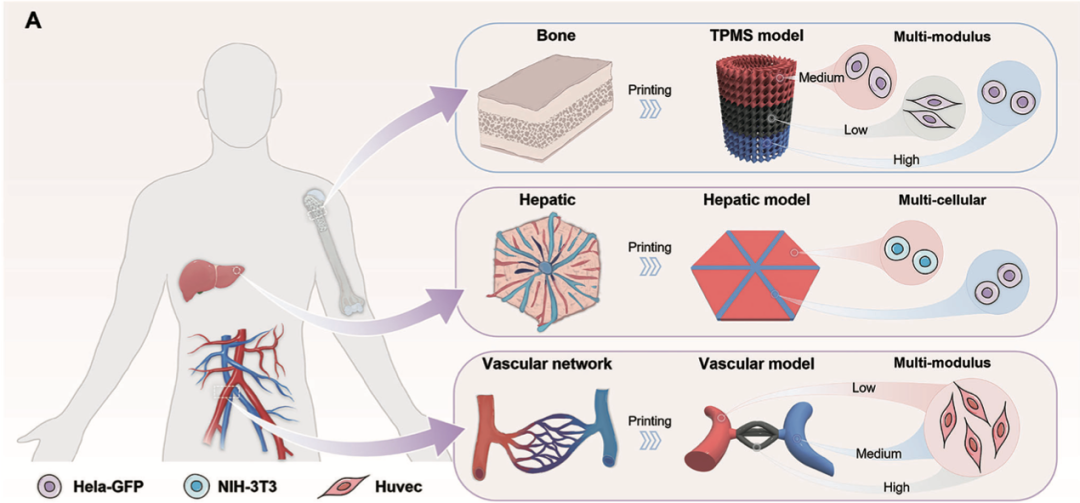
对于骨组织、肝小叶和血管网络的体外建模,使用多材料DLP3D打印制造细胞嵌入水凝胶结构和抑制剂的各种机械特性,确保细胞分布的空间准确性(yang et al., 2024)
技术特点
生物墨水的性能
快速固化与高精度平衡:50 wt% 浓度的 PEGDA-AAm 墨水可在 3.5 秒内完成光固化,储能模量(G')达 210 kPa,较传统 GelMA 墨水提升 10 倍以上,同时实现 30 μm 的打印分辨率。
可灌注网络构建
微通道一体化成型:利用 DLP 技术的光固化精度,直接打印出直径 100 μm 的螺旋形、树状微通道,通道内灌注 NIH-3T3 细胞后,与周边 Hela-GFP 细胞形成清晰的分区边界,细胞存活率超 90%。
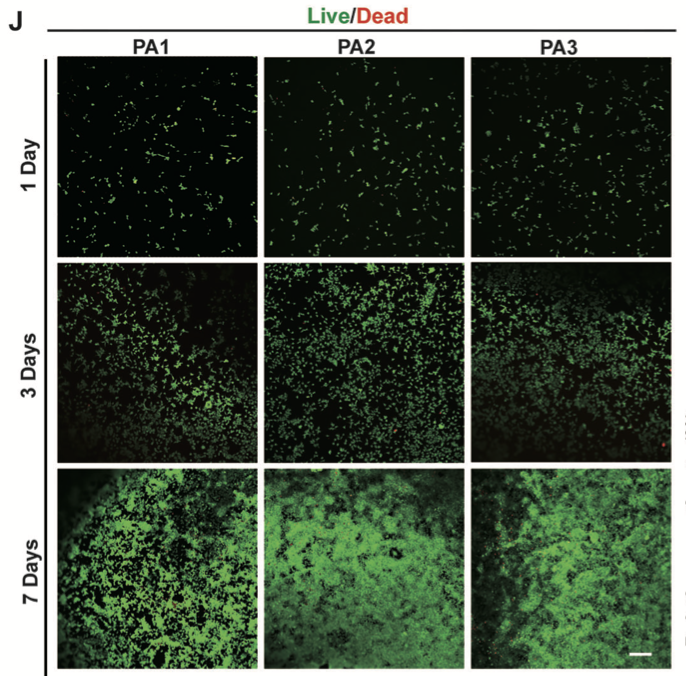
在PA1、PA2和PA3水凝胶(尺寸:π×2mm×2mm×1mm)上培养的NIH-3T3细胞共聚焦显微镜图像,用于活/死染色测定。比例:200μm (yang et al., 2024)
表面拓扑工程
螺旋沟槽与 TPMS 结构:打印表面设计周期性螺旋沟槽(间距 50 μm)和三重周期最小曲面(TPMS),引导平滑肌细胞沿沟槽方向排列,或在 TPMS 孔隙内形成环形聚集,细胞分化效率提升。

印刷水凝胶空心管表面螺纹图案的代表性明场图像。比例:400微米(yang et al., 2024)
核心材料
PEGDA-AAm 生物墨水的设计与优化
配方组成:以丙烯酰胺(AAm)和聚乙二醇二丙烯酸酯(PEGDA)为基质,锂苯基 - 2,4,6 - 三甲基苯甲酰基膦酸锂(LAP)为光引发剂,通过调节 PEGDA:AAm 比例(2%~10%)及浓度(20%~50 wt%),实现水凝胶力学性能的宽域调控。
性能优势:50 wt% 浓度墨水的凝胶化时间(Tgel)仅 2.75 秒,储能模量(G')可达 210 kPa,较传统 GelMA 墨水提升 10 倍以上,同时保持 90% 以上的细胞存活率。
多材料 DLP 打印工艺的突破
光固化参数优化:采用 405 nm LED 光源(100 mW/cm²),通过调节光照能量(0.022~0.3 mJ)和添加 1% 光吸收剂,将打印分辨率提升至 30 μm,有效减少光散射导致的结构畸变。
异质结构构建策略:通过分区打印不同模量的水凝胶(如 PA1:45 kPa,PA3:210 kPa),结合界面固化技术,实现力学梯度结构的无缝集成。
应用场景与技术拓展
组织工程与器官模型构建
肝脏小叶仿生模型
通过多材料 DLP 技术打印的六边形肝脏小叶模型,采用 2% PEGDA-AAm(PA₁,45 kPa)模拟肝板基质,10% PEGDA-AAm(PA₃,210 kPa)构建血管通道网络。共培养实验显示,NIH-3T3 细胞与 Hela-GFP 细胞在不同模量区域实现空间分区,且细胞存活率均超过 90%。该模型通过低强度 UV 光(100 mW/cm²)打印,避免了光毒性对细胞的损伤,为肝脏组织功能研究提供了体外平台。
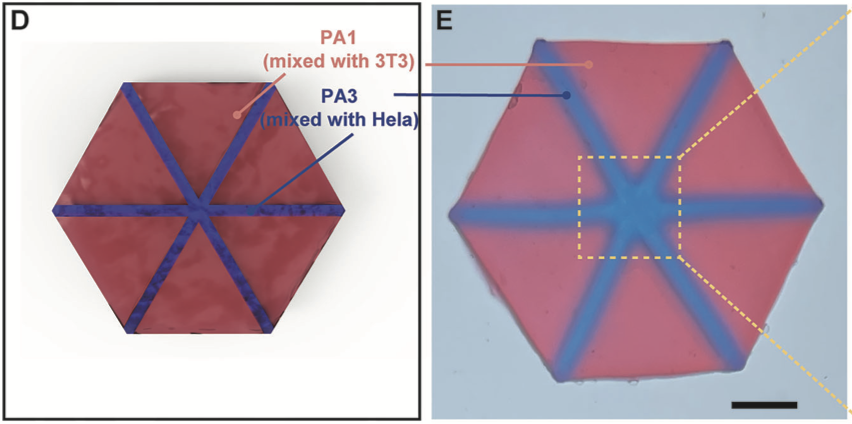
D)基于STL文件的示意图说明了多材料水凝胶的exagon设计,以模拟模拟模拟的肝小叶结构。配置的特点是SAR彩色PA1水凝胶基质,并穿插着蓝色PA3水凝胶通道网络。这些通道在中心收敛到人形“X”图案。E)光学图像显示使用细胞填充PA1和细胞填充PA3生物墨水的实际制造样品,捕获六边形配置。刻度条:2毫米。(yang et al., 2024)
血管化网络构建
成功打印包含动脉(红色 PA₂,130 kPa)、静脉(蓝色 PA₁,45 kPa)和毛细血管(黑色 PA₃,210 kPa)的三维血管网络,通道直径覆盖 5 μm 至 10 mm,光固化精度达 100 μm。灌注实验中,内皮细胞在通道内 7 天形成连续 CD31 阳性内皮层,证明其具备血流模拟功能。该网络通过调节 PEGDA-AAm 比例实现力学梯度匹配天然血管系统,例如动脉段的高弹性模量(130 kPa)可减少血流冲击导致的破裂风险。

K)基于ASTL文件的3D血管网络模型的示意图设计是自然血管系统。它包括多个组件,红色、蓝色和黑色分别表示动脉、静脉和毛细血管,突出了血管结构的详细组织。L)显示多材料3D水凝胶血管网络的实际打印样本的光学图像。它由三个不同的相互连接的段组成:最柔软的段由右侧的红色PA1动脉表示,最坚硬的黑色PA3毛细血管在中间,左侧以蓝色染色的PA2静脉为代表。并指示水凝胶血管网络中相应区域的剖面视图和放大视图。刻度杆:2毫米。(yang et al., 2024)
骨组织工程支架
利用三重周期最小曲面(TPMS)结构设计的骨支架,采用 PA₃(210 kPa)打印,其孔隙率达 60% 且具有周期性凹凸表面。体外实验显示,成骨细胞在 TPMS 结构的 “脊状” 区域聚集生长,细胞形态呈纺锤形,符合骨细胞分化特征。该支架的压缩模量(475 kPa)接近天然皮质骨(≈300 kPa),为骨缺损修复提供了力学适配的载体。

M)具有TPMS设计的水凝胶空心管。左侧的图像说明了具有三周期最小表面(TPMS)地形的水凝胶空心管的设计,右侧显示了相应的印刷样品,使用PA2生物油墨准确复制TPMS设计。比例:1mm.N)代表性和详细的扫描电子显微镜(SEM)图像显示了印刷水凝胶空心管表面TPMS图案的微观结构。比例:200微米。(yang et al., 2024)
肿瘤微环境模拟与药物筛选
肿瘤侵袭行为研究
在 TPMS 结构的异质水凝胶中,Hela-GFP 细胞在 PA₁(40 kPa)软基质区域表现出更强的迁移能力,细胞呈纺锤形向外扩张,迁移速率较 PA₂(130 kPa)区域提升 40%。而在 PA₃(210 kPa)硬基质中,细胞主要聚集在孔隙内,形态呈圆形,侵袭性显著降低。这一结果表明基质硬度可调控肿瘤细胞的迁移表型,为研究肿瘤转移机制提供了体外模型。
微流体芯片与器官芯片应用
成功制备包含直形与气管状通道的微流体芯片,采用 20 wt% PA 生物墨水(PEGDA:AAm=500%)打印,通道内可灌注不同荧光标记的细胞(如绿色 Hela-GFP 与蓝色 NIH-3T3),形成清晰的细胞分区边界。该芯片通过光固化时间控制(<5 秒)减少细胞光损伤,适用于构建 “肿瘤 - 血管” 互作模型,例如模拟肿瘤细胞通过血管通道的侵袭过程。

B)两个DLP印刷水凝胶结构的光学图像,具有空心可渗透微通道,由20 wt%的PA生物墨水制成,PA比为500%。C、)共聚焦荧光显微镜图像显示绿荧光Hela-GFP细胞嵌入在水凝胶结构中,微通道明显由蓝荧光NIH-3T3细胞标记。刻度条在C中分别为500微米。(yang et al., 2024)
研究总结与行业意义
该研究通过多材料 DLP 生物打印技术,首次实现了异质水凝胶结构的 “力学 - 结构 - 功能” 三位一体构建:
材料层面:PEGDA-AAm 墨水突破了传统生物墨水的力学局限,为硬组织工程提供了新载体
技术层面:光固化参数优化与多材料集成工艺,将 DLP 打印的应用场景从简单结构拓展至复杂器官模拟
应用层面:可灌注网络与表面拓扑调控技术,为肿瘤微环境研究、个性化药物筛选提供了更真实的体外模型
参考文献:Yang, M., Chu, L., Zhuang, Y., Qi, C., Meng, S., Liu, Z. and Kong, T. 2024. Multi‐Material Digital Light Processing (DLP) Bioprinting of Heterogeneous Hydrogel Constructs with Perfusable Networks. Adv. Funct. Mater.
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的高新技术企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。


