《Nature Communications》生物3D打印定制胰岛特异性微环境

研究背景:干细胞衍生胰岛成熟的关键障碍
胰腺中的胰岛是调节血糖稳态的核心结构,其功能依赖于多种激素分泌细胞(包括β细胞、α细胞等)与细胞间信号、细胞外基质(ECM)、血管网络等复杂微环境之间的协同作用。尽管近年来干细胞分化技术不断取得进展,研究发现:“干细胞来源的胰岛类细胞在体外培养条件下通常表现为发育不成熟,缺乏三维结构支持与血管微环境,导致其响应葡萄糖的胰岛素分泌能力严重受限。”值得注意的是,该类细胞移植入体内后,功能可逐渐成熟,提示体外培养体系中缺乏某些关键性的环境因子,成为其临床转化的一大瓶颈。此外,尽管已有研究尝试引入单一的基底膜蛋白或使用脱细胞基质(dECM)重建微环境,但由于脱细胞过程中关键基质成分(如层粘连蛋白、IV型胶原蛋白)常被破坏,因此:“尚未有研究系统性整合pdECM与基底膜蛋白共同构建高度仿生的胰岛微环境。”血管网络作为胰岛功能维持的基础,在传统二维共培养模型中亦无法真实还原其三维空间关系和功能协同,成为进一步优化体外胰岛模型的研究空白。
技术亮点:仿生胰岛微环境的系统构建策略
开发胰岛特异性生物墨水(PINE)
研究团队结合胰腺特异性dECM与关键基底膜蛋白,构建了具有高度仿生特征的PINE(peri-islet niche-like ECM)生物墨水。
成分优势:pdECM中富含胰腺组织特有的胶原蛋白VI/I/VIII、糖蛋白(如dermatopontin)和蛋白聚糖(如mimecan),组成更贴近天然胰岛环境;为补充脱细胞过程造成的基底膜蛋白损失,进一步引入1:1比例的层粘连蛋白与IV型胶原蛋白。
功能增强:使用PINE培养的SC衍生胰岛细胞在INS与CHGA表达水平上均显著提升,同时在高糖刺激下胰岛素分泌和钙信号活性也明显增强,表明其更有助于β细胞向功能成熟状态的转化。
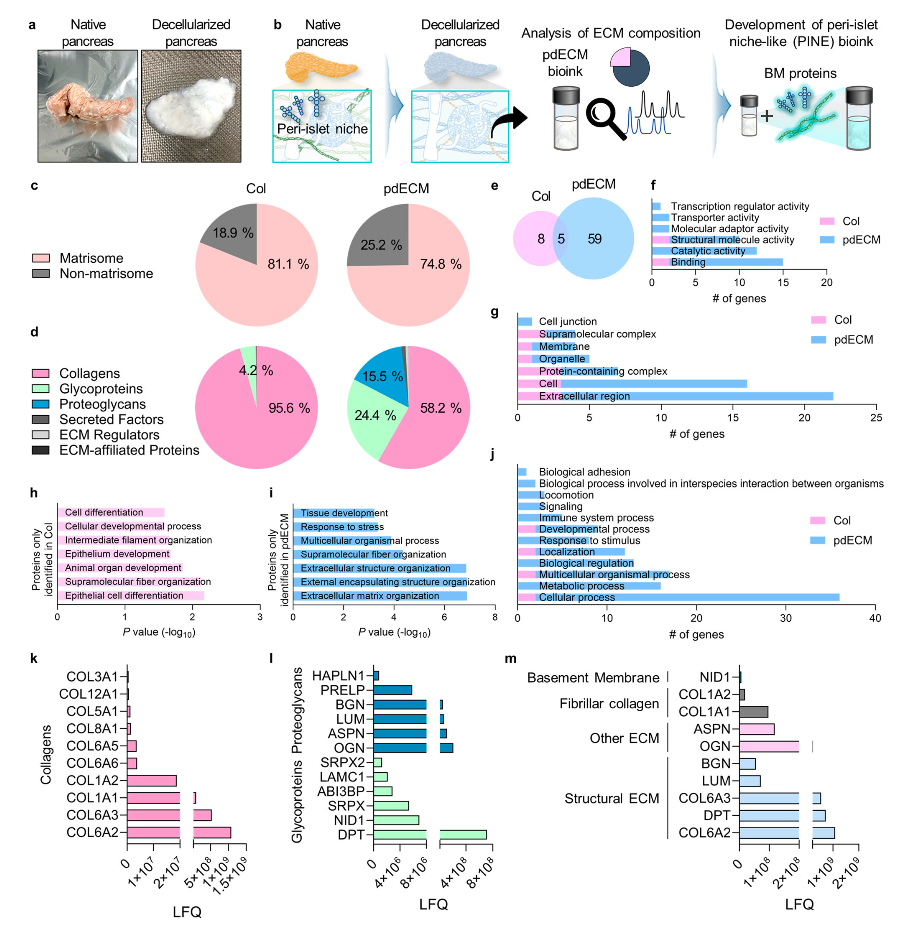
Col和pdECM生物墨水的蛋白酶体表征 (Myungji et al., 2025)
构建类胰岛-血管三维模型(HICA-V)
研究进一步通过bath bioprinting策略构建胰岛样细胞聚集体-血管网络(HICA-V),实现结构仿生与空间精控。
打印流程:先以PEVA材料构建三维支架框架,再在PINE生物墨水中分别打印负载HUVEC的血管结构与SC衍生胰岛细胞团,使其间距精确控制在50 μm以内,从解剖学尺度上模拟天然胰岛与血管的紧密关系。
结构表现:RFP标记实验显示,血管形成毛细血管芽并逐渐与胰岛聚集体融合,内皮细胞主要聚集于血管结构区域,空间分布与体内结构高度一致。
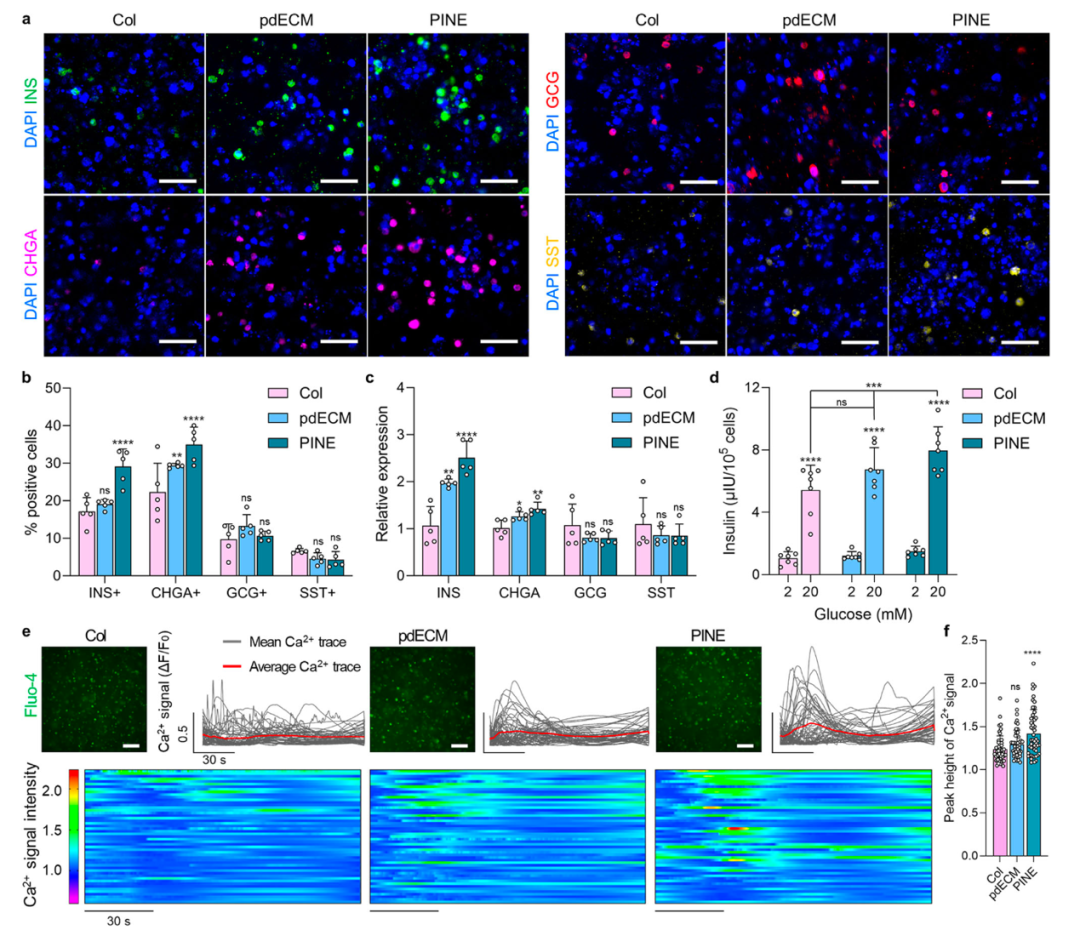
微环境对SC衍生β细胞成熟的影响的研究(Myungji et al., 2025)
研究结果:结构仿生促进功能重建
PINE生物墨水提升胰岛细胞成熟性
分子层面:β细胞成熟关键基因如CX36、VE-CAD在PINE组表达显著上调。CX36作为细胞间连接蛋白,对胰岛细胞对葡萄糖的响应极为重要。
功能层面:葡萄糖刺激试验显示,PINE组胰岛样结构在基础与刺激状态下胰岛素分泌量分别为随机分布组的3.63倍与3.82倍,且刺激指数保持稳定,证实其具备更成熟的分泌能力。
HICA-V复现胰岛与血管功能协同机制
细胞通讯:CX36、CX43、VE-CAD等关键连接蛋白在HICA-V模型中高表达,提示内皮细胞与胰岛细胞之间存在有效旁分泌机制。
例如:胰岛素可促进内皮细胞eNOS表达,内皮细胞分泌的FGF亦促进β细胞存活与增殖,构成双向正反馈。
代谢响应:高糖刺激下,HICA-V模型的胰岛素分泌动力学曲线更接近天然胰岛,具备良好的功能保留。
疾病建模与药物评估能力
模拟糖尿病状态:HICA-V置于高糖环境下,IL-6、VCAM-1等炎症指标上调,模拟糖尿病血管炎性反应。
药物测试表现:联合应用二甲双胍和SGLT2抑制剂恩格列净处理后,炎症水平下降,CD31标记的血管结构与胰岛素表达得到恢复,说明该模型具备疾病建模与药效评价双重潜力。
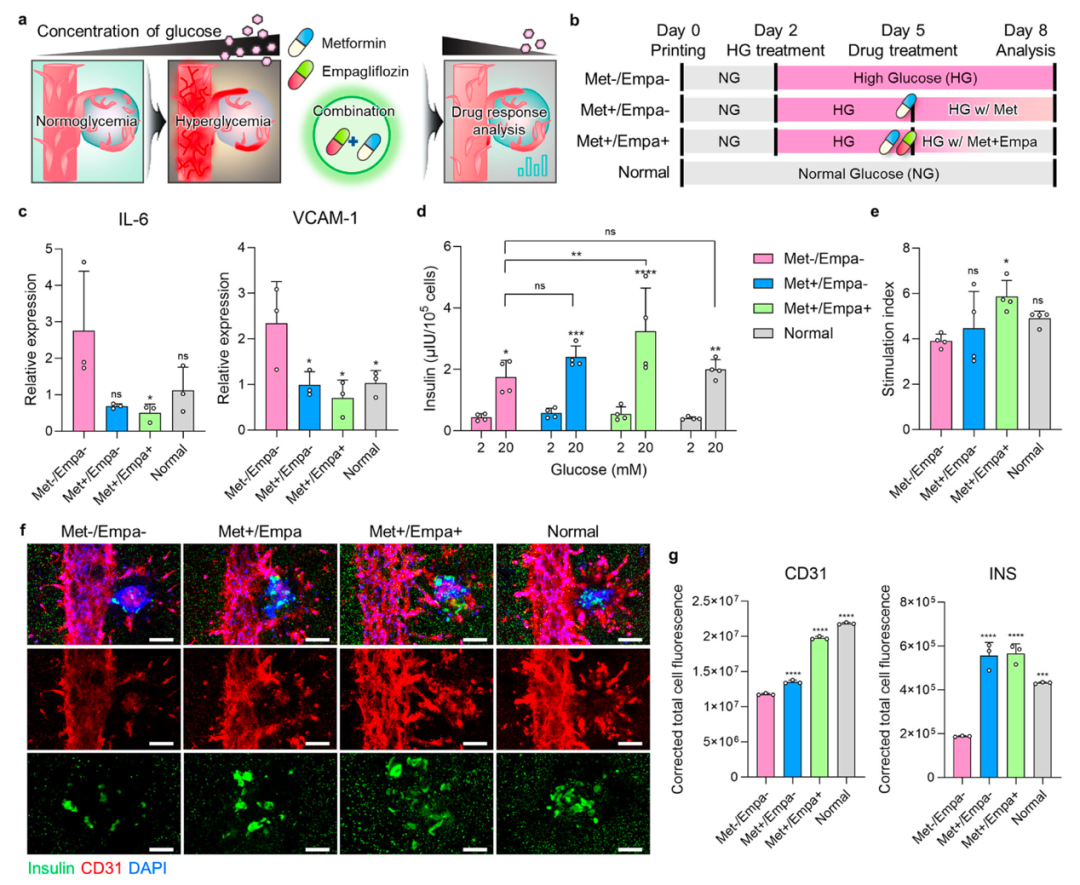
通过诱导高血糖样条件来演示HICA-V的体内模仿病理生理现象(Myungji et al., 2025)
应用前景:推动胰岛模型从基础研究迈向临床转化
糖尿病体外建模平台
HICA-V可精确模拟从健康至糖尿病状态的微环境变化,为研究高糖环境下的胰岛-血管协同损伤机制提供了高保真体外模型。
药物筛选与机制研究
该系统可同时评估候选药物对β细胞功能和血管状态的影响,为SGLT2抑制剂、GLP-1激动剂等新型药物的体外筛选提供更具预测力的模型平台。
干细胞移植前成熟平台
PINE生物墨水与HICA-V结构为SC衍生胰岛细胞提供了类生理成熟环境,并具备良好血管整合潜力,未来可用于胰岛移植前体外成熟体系,提升存活率与功能维持时间。
研究局限与展望
尽管本研究取得重要进展,但仍存在以下局限:
模型未纳入胰岛周细胞和神经成分,而这类细胞在调节血流与代谢反馈中同样关键;
当前使用的HUVECs在表型上难以完全模拟胰腺特异性内皮细胞的异质性特征;
未来可结合单细胞转录组技术,进一步优化细胞选择与异质性调控策略。
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的高新技术企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。
肺癌
宫颈癌
结直肠癌
卵巢癌
脑胶质瘤
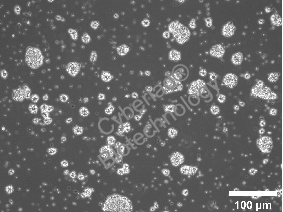
神经母细胞瘤
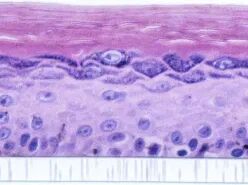
黑色素皮肤模型

全层皮肤模型
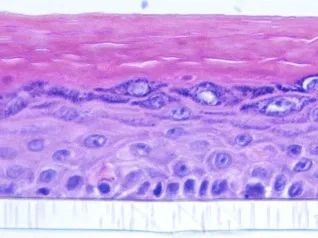
表皮模型


