《Advanced Healthcare Materials》:生物3D打印神经血管单元模型精准模拟GBM肿瘤生长

研究概述
由于当前用于药物发现和开发的体外细胞实验缺乏生理相关性,无法可靠预测临床结果。此外,GBM作为一种成人大脑癌症,具有高复发率和预后差的特点,且现有药物筛选平台无法模拟GBM的遗传异质性和肿瘤微环境。针对这些问题,美国国家转化医学推动中心的Ming Jae Song以及Marc Ferrer博士在《Advanced Healthcare Materials》上发表了“A 3D Bioprinted Human Neurovascular Unit Model of Glioblastoma Tumor Growth”。本文构建了包含人源星形胶质细胞、周细胞、脑微血管内皮细胞和患者来源GBM细胞的3D NVU模型,用于研究GBM在类似大脑微环境中的生长。通过高内涵成像技术,该模型可量化微血管网络和肿瘤生长情况。实验表明,NVU-GBM模型具有与临床GBM相似的特征,并可用于高通量筛选药物,评估其药理相关性和有效性。
生物3D打印在本研究中的作用
生物3D打印技术在构建三维神经血管单位 (NVU) 模型中发挥了关键作用,该模型模拟了GBM肿瘤在脑部微环境中的生长。它将不同类型的细胞按照特定的空间排列组装在一起,形成类似人体神经血管单位的结构,从而更真实地模拟了GBM肿瘤的生长情况,并提高了实验的可控性和可重复性。
主要内容

细胞组成
环形的NVU结构促进了血管生成,并方便了对血管生成和GBM肿瘤生长的定量分析。免疫荧光染色证实了NVU模型中存在内皮细胞、星形胶质细胞和周细胞,并形成了血管网络。
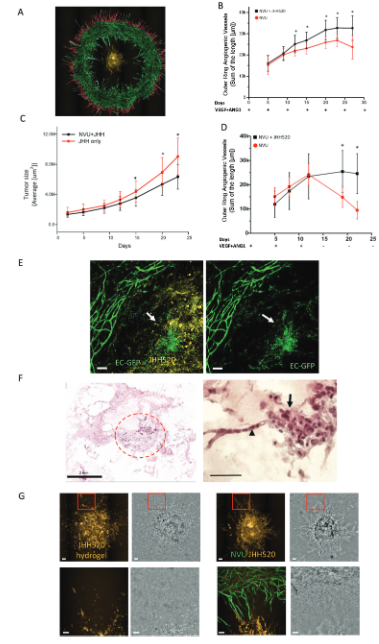
肿瘤生长情况
NVU模型与GBM细胞共培养后,血管生成和肿瘤生长都发生了变化。外向血管生成增加,而内向血管生成减少。肿瘤生长在NVU模型中受到抑制,并表现出血管拟态的特征。

人体生理环境模拟
NVU模型中内皮细胞、星形胶质细胞和周细胞的基因表达发生了显著变化,包括血管生成、细胞外基质组织和炎症相关基因的上调。
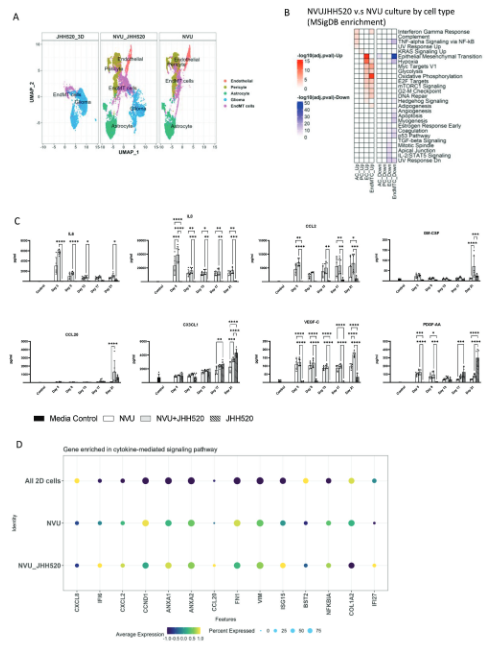
基因表达变化
GBM细胞诱导了内皮细胞、星形胶质细胞和周细胞基因表达谱的改变,包括细胞代谢、间充质转化、炎症反应相关基因的上调,以及血管生成和细胞迁移相关基因的下调。

NVU模型对GBM细胞影响
NVU共培养环境下,GBM细胞的基因表达更接近临床GBM样本,并表现出糖酵解、细胞因子信号通路和血管生成相关基因的上调。
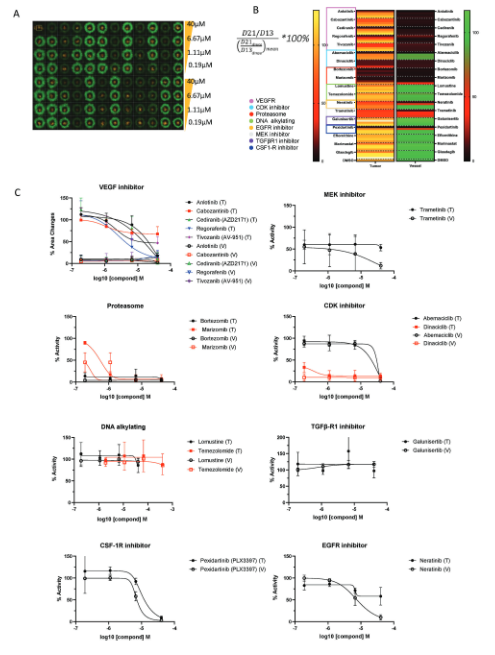
药物筛选
多种药物能够抑制血管生成,而VEGFR抑制剂能够同时抑制血管生成和肿瘤生长。CDK抑制剂对血管生成和肿瘤生长的抑制作用具有不同的效力。
总结
本研究通过3D生物打印技术构建了具有生理相关性的NVU模型,并将其与患者来源的GBM肿瘤细胞结合,形成了NVU-GBM模型。该模型成功模拟了GBM肿瘤生长的微环境,并展现了肿瘤与血管之间的相互作用,例如肿瘤诱导的血管生成和血管拟态。单细胞RNA测序分析揭示了NVU模型中细胞基因表达的显著变化,包括血管生成、细胞外基质组织和炎症相关基因的上调,证实了该模型的生理相关性。未来,该模型有望推动GBM治疗药物的研发,并为个性化医疗提供新的思路。
文献原文:10.1002/adhm.202302831
文献链接:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202302831
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的科创企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。

肺癌

宫颈癌

结直肠癌

卵巢癌

脑胶质瘤
神经母细胞瘤
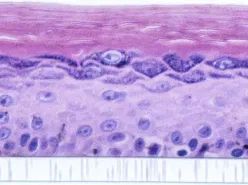
黑色素皮肤模型

全层皮肤模型
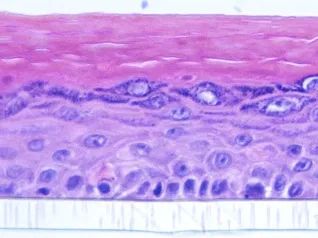
表皮模型


